服务热线
iLiver 应用|淇嘉科技联合战略合作方中科普瑞昇,助力药物肝毒性研究
发布时间:
2025-06-04
肝毒评价的困境
近30年来,由肝毒(即药物性肝损伤,DILI)造成的临床失败率高达22%。而在临床经过数千例患者的受试却未能发现,直到药物上市后才因毒性事件被下架的案例中,DILI占比达到了惊人的32% [1, 2]。正是由于隐匿性强、事故率高的特点,DILI如同一个隐形杀手,对广大患者造成了巨大健康威胁。因此,DILI的精准评价一直被认为是新药早研的重中之重。
在传统肝毒评价方法中,常使用2D细胞培养模型,如原代肝细胞 (PH)、肝癌细胞系 (如HepG2)、以及 iPSC源2D肝样细胞 (iPSC-HLC) 进行DILI测试。然而,PH在体外培养过程中会自发性地去分化,导致代谢活性迅速降低,功能性维持时间往往≤72h [5, 6];而HepG2由于缺失P450关键药物代谢酶,其结果的临床拟合度差 [3, 4];iPSC-HLC则因成熟度欠佳,尚无法重现足够肝功 [7, 8]。
破局者:3D 肝类器官
随着近年类器官技术的迅猛发展,不断累积的报道案例表明:人肝类器官能够精准地重现DILI [至少3篇]。如 2019 年 Mun SJ等人发表于《Journal of Hepatology》、以及 2022 年 Kim H团队在《Biomaterials》发表的研究表明, iPSC 衍生肝类器官,在药物毒性评估方面具有显著优势, 其灵敏度可达88.7% [9,10]。
淇嘉科技 iLiver产品肝毒评价效果
•iLiver 细胞构成接近真实肝脏(70% 肝细胞,7%胆管细胞,1% Kupffer细胞,10% 肝星状细胞 VIM+),并支持长达 10 天的功能性维持时窗。(了解iLiver详细性能)
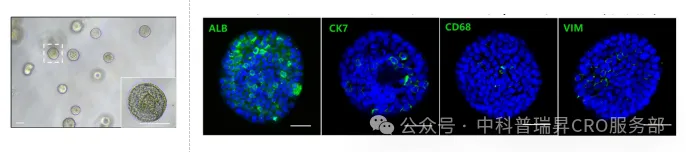
图1 iLiver 谱系情况
•iLiver 高表达药代酶,整体表达水平近似于成年原代肝组织
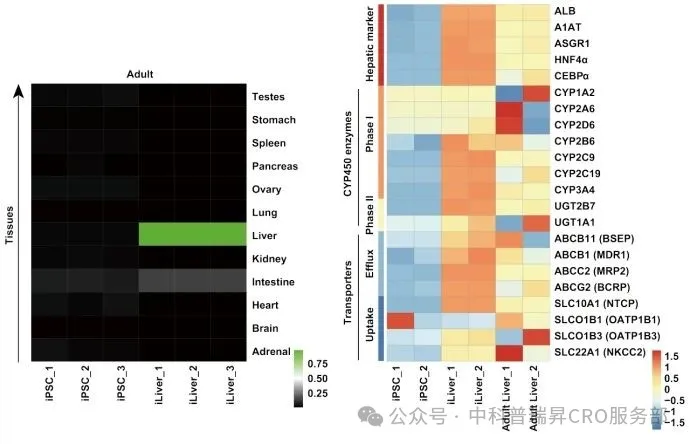
图2 iLiver 药物代谢酶家族表达结果
•iLiver 能够精准评价DILI(高灵敏性及特异性)
表1 基于 iLiver 模型预测 46 种上市药物的肝毒性
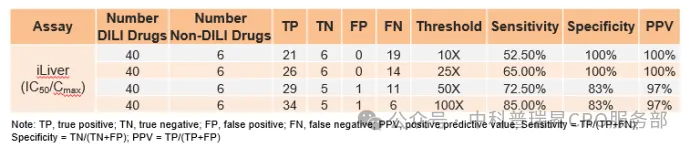
代表性案例
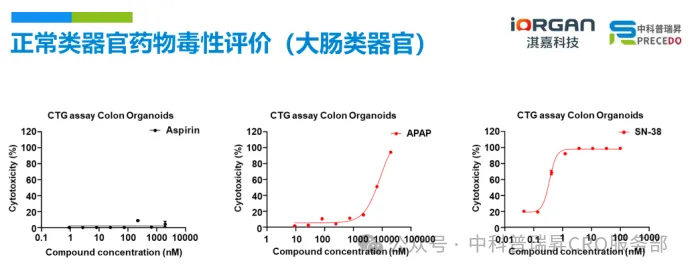
近期,我们和战略合作伙伴中科普瑞昇共建了 iLiver 和 iColon 的药物毒性评价体系。
•使用 iLiver 评价药物体外毒性,结果显示,阴性对照 Aspirin 对肝类器官没有毒性,而 SN-38(ADC Payload)表现出明显的肝毒性。
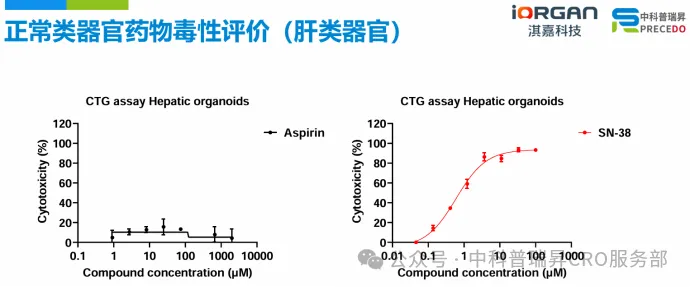
•使用 iColon 评价药物体外毒性,结果显示,阴性对照 Aspirin 对肝类器官没有毒性,而对乙酰氨基酚(APAP)和 SN-38(ADC Payload)表现出明显的肠毒性。(了解 iColon 详细性能)
此次淇嘉科技与中科普瑞昇的战略合作,是类器官技术在药物安全性评价领域从科研向产业化的关键跨越。未来,双方将持续深化 iLiver 平台在药物代谢、毒性评价、肝病模型构建等领域的应用,携手推动临床前药物安全评价范式的革新,加速药物研发进程。
若您想了解更多关于 iORGAN 体系药物毒性评价及产品等信息,请扫描下方二维码与我们联系。

参考文献:
1.Bakke O M, Manocchia M, de Abajo F, et al. Drug safety discontinuations in the United Kingdom, the United States, and Spain from 1974 through 1993: a regulatory perspective[J]. Clinical Pharmacology & Therapeutics, 1995, 58(1): 108-117.
2.Watkins P B. Drug safety sciences and the bottleneck in drug development[J]. Clinical Pharmacology & Therapeutics, 2011, 89(6): 788-790.
3.Tolosa L, Pinto S, Donato MT, Lahoz A, Castell JV, O’Connor JE, et al. Development of a multiparametric cell-based protocol to screen and classify the hepatotoxicity potential of drugs. Toxicol Sci. 2012;127(1):187–98.
4.Saito J, Okamura A, Takeuchi K, Hanioka K, Okada A, Ohata T. High content analysis assay for prediction of human hepatotoxicity in HepaRG and HepG2 cells. Toxicol Vitro. 2016;33:63–70.
5.Gómez-Lechón MJ, Tolosa L, Conde I, Donato MT. Competency of different cell models to predict human hepatotoxic drugs. Expert Opin Drug Metab Toxicol. 2014;10(11):1553–68.
6.Guo L, Dial S, Shi L, Branham W, Liu J, Fang JL, et al. Similarities and differences in the expression of drug-metabolizing enzymes between human hepatic cell lines and primary human hepatocytes. Drug Metab Dispos. 2011;39(3):528–38.
7.Gao X, Li R, Cahan P, Zhao Y, Yourick JJ, Sprando RL. Hepatocyte-like cells derived from human induced pluripotent stem cells using small molecules: implications of a transcriptomic study. Stem Cell Res Ther. 2020;11(1):393.
8.Siller R, Greenhough S, Mathapati S, Si-Tayeb K, Sullivan GJ. Future challenges in the generation of hepatocyte-like cells from human pluripotent stem cells. Curr Pathobiology Rep. 2017;5(3):301–14.
9.Mun SJ, Ryu JS, Lee MO, Son YS, Oh SJ, Cho HS, et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. J Hepatol. 2019;71(5):970–85.
10.Kim H, Im I, Jeon J S, et al. Development of human pluripotent stem cell-derived hepatic organoids as an alternative model for drug safety assessment[J]. Biomaterials, 2022, 286: 121575.
11.Shinozawa T, Kimura M, Cai Y, et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell–derived organoids[J]. Gastroenterology, 2021, 160(3): 831-846. e10.

中科普瑞昇公众号

创新药物评价

中科医脉小程序
电话:4006 0551 06(官方热线)
0551—67129201(公司总部)
网址:www.precedo.cn
地址:合肥市高新区习友路国家健康大数据产业园A6栋


